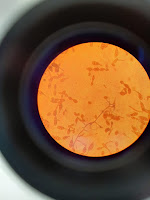
Práctica 21. Siembra en anaerobiosis

Siembra en anaerobiosis 18-2-2020 Objetivo En esta práctica vamos a realizar el crecimiento de microorgansmos en anaerobiosis Materiales --> Placa petri con agar sangre --> Mechero --> Hisopo --> Jarra de anaerobiosis --> Estufa --> Microscopio Procedimiento 1.Pasamos un hisopo por la boca para recoger el microorganismo 2.Sembramos la placa con agar sangre por agotamiento de estrias 3.Colocamos la placa en la jarra de anaerobiosis y colocamos un sobre abierto de GENbox anaer. 4.Incubamos a 37º durante 24 h